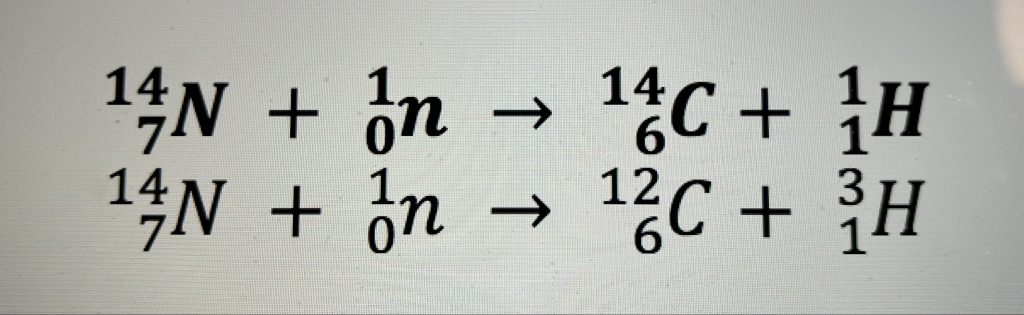Willard Frank Libby y el C-14
Hace varias semanas la televisión pública emitió un documental, en el programa Crónicas de La 2, sobre el trabajo que los científicos realizan en Atapuerca (Burgos) y las razones por las que este yacimiento ha revolucionado las teorías sobre la evolución humana. Uno de los aspectos clave que se trata en el reportaje versa acerca de la antigüedad de los restos hallados y de los métodos de datación de los mismos. Una de las técnicas que destaca por su relevancia en la historia de la arqueología y de la antropología y, más concretamente, en la datación de especímenes orgánicos, se basa en la utilización del C-14. En cualquier caso, y a pesar de la importancia de este radioisótopo, ha de mencionarse la necesidad de otras técnicas de datación, puesto que, en lo referente al C-14, este método únicamente permite determinar la edad de materia orgánica de no más de 50 000 o 60 000 años de antigüedad. Esta es la razón por la que en Atapuerca utilizan un abanico de procedimientos variados, que les permite llegar a evaluar la edad de fósiles de hasta 3 millones de años de antigüedad. El reportaje puede aún disfrutarse en rtve.es: https://www.rtve.es/play/videos/cronicas/revolucion-atapuerca/6116725/
La contribución del C-14 a poner orden en la historia de la humanidad es la razón por la que dedico este artículo tanto a este interesante isótopo como a Willard Libby, padre del método de datación basado en el mismo.
Willard Frank Libby fue un químico estadounidense (Colorado, 1908 – California, 1980) galardonado con el Premio Nobel de Química en 1960, en palabras de la Academia Sueca, “por su método para usar carbono-14 para la datación de la edad en arqueología, geología, geofísica y en otras ramas de la ciencia”.
Libby trabajó como profesor e investigador. Desde 1959 ejerció como profesor de química en la Universidad de California y, desde 1962, también como director de su Instituto de Geofísica y Física Planetaria, hasta su muerte. Por toda su trayectoria recibió numerosos honores, premios y títulos honoríficos, el Nobel entre ellos. Pero anteriormente a esa época, trabajando como profesor de química en la Universidad de Princeton, su trabajo fue interrumpido por la entrada de Estados Unidos en la Segunda Guerra Mundial. Esto motivó que fuera enviado a la División de Investigación de Guerra de la Universidad de Columbia, donde trabajó con otro Nobel de Química, Harold C. Urey, hasta 1945. Desde entonces y hasta 1959, fue profesor en el Instituto de Estudios Nucleares (hoy Instituto Enrico Fermi) y en la Universidad de Chicago. En esta época, concretamente de 1955 a 1959, fue designado por el presidente Eisenhower para formar parte de la Comisión de Energía Atómica. Su compromiso con la Guerra Fría, su participación en el Proyecto Manhattan (contribuyó a desarrollar un método de separación de los isótopos de uranio mediante difusión gaseosa) así como sus declaraciones como ferviente defensor de las armas nucleares, por no hablar de su oposición a la concesión a Linus Pauling de los Nobel de Química y de la Paz (por su defensa de la prohibición de las armas nucleares), no han contribuido a que su figura como ilustre persona de ciencia sea venerada como merece. En cualquier caso los logros siempre sobreviven a los personajes que los alcanzan, tanto en el caso de los de índole científica como en los concernientes a otras disciplinas; y el del radiocarbono de Libby no es una excepción.
En 1939 el físico norteamericano Serge Korff descubrió que la atmósfera terrestre era constantemente bombardeada por rayos cósmicos de gran poder de penetración. Estos rayos, que se originan en el espacio exterior, están constituidos por electrones, neutrones y núcleos atómicos. Una de las reacciones importantes entre la atmósfera y los rayos cósmicos es la captura de neutrones por el nitrógeno atmosférico (N-14) para producir el isótopo radiactivo C-14 e hidrógeno (H-1) (con una frecuencia mucho menor otros posibles productos son C-12 y H-3 o “tritio”):
Los átomos de C-14, inestables, finalmente forman 14CO2, que se mezcla con el dióxido de carbono común, 12CO2, en el aire.
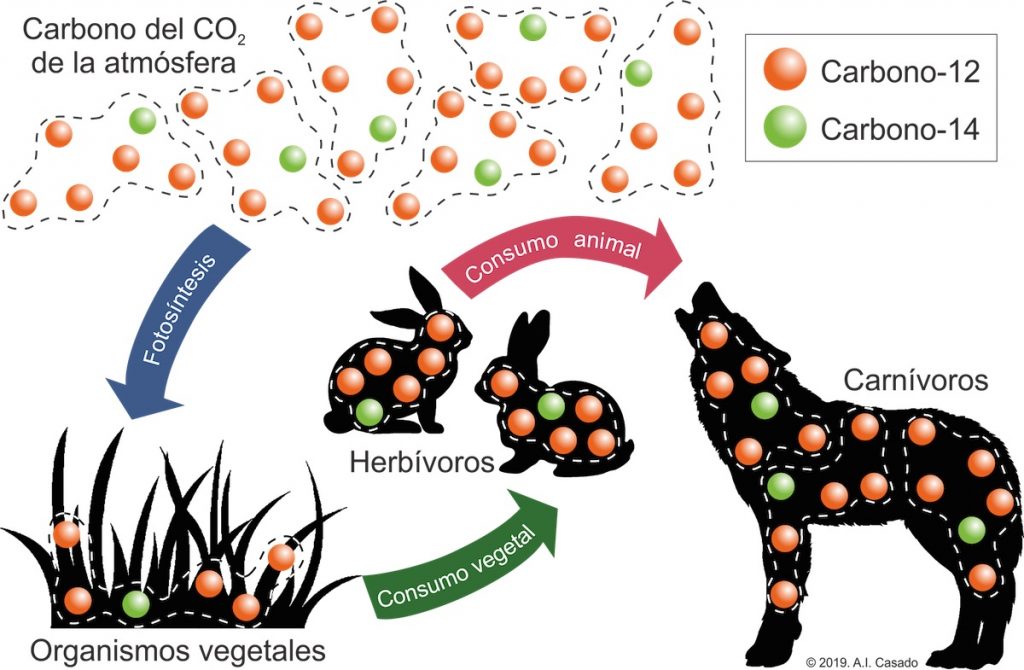
Los isótopos de C-14 entran en la biosfera, donde las plantas toman el dióxido de carbono para la fotosíntesis. Los animales se comen las plantas y exhalan el C-14 como CO2.
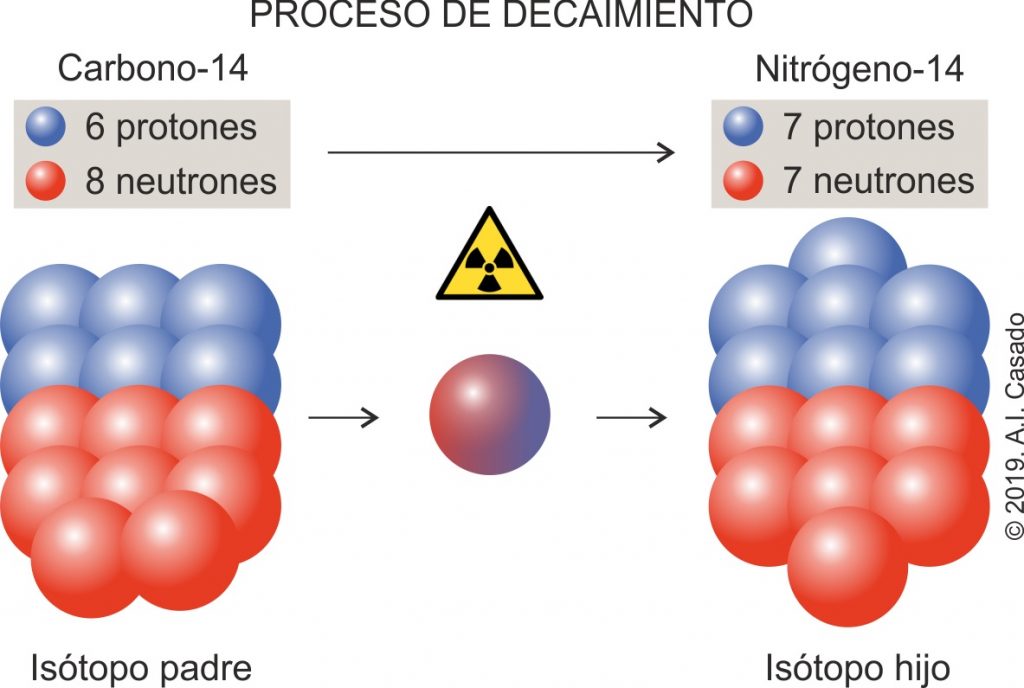
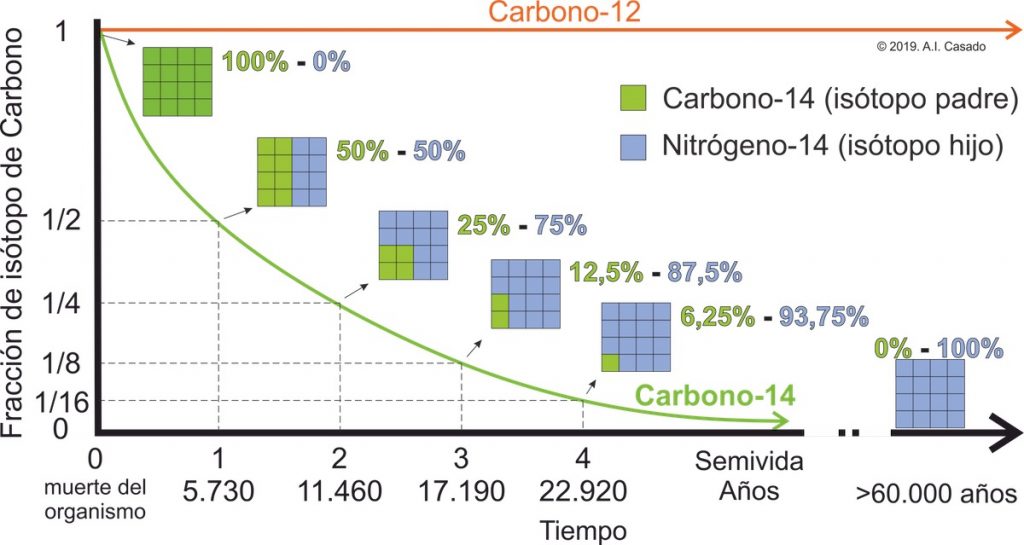
El C-14 participa en muchos aspectos del ciclo del carbono. Los isótopos que se pierden por desintegración radiactiva se renuevan constantemente por la producción de otros nuevos en la atmósfera. En estos procesos de desintegración-renovación se establece un equilibrio dinámico donde la relación C-14/C-12 permanece constante en la materia viva. Pero cuando una planta o un animal mueren, el C-14 no vuelve a renovarse, por lo que la relación disminuye debido a la desintegración del C-14. Este mismo cambio le sucede a los átomos de C del carbón, del petróleo, de la madera del subsuelo y, en general, de cualquier material con componentes orgánicos.
En 1955, Willard Libby sugirió que este hecho podría utilizarse para calcular el tiempo que el isótopo C-14, de un espécimen orgánico en particular, ha continuado desintegrándose sin renovarse. Para ello determinó el periodo de semidesintegración (o semivida – tiempo que transcurre hasta la desintegración de la mitad de los núcleos iniciales) del C-14 con un valor de 5568 años; determinaciones posteriores arrojaron un valor de 5730 años.
Además, conociendo que el isótopo C-14 emite, por desintegración, partículas beta (electrones) y que la velocidad de desintegración, que se mide por el número de electrones emitidos por segundo, sigue una cinética de primer orden, se establece la ley de velocidad de acuerdo con la ecuación: v = kN, donde k es la constante de velocidad de primer orden y N el número de núcleos de C-14 presentes. Esta ecuación, que expresa que la velocidad de desintegración es directamente proporcional al número de núcleos de C-14 presentes, junto con el valor del periodo de semidesintegración, permiten deducir k. Si, además, se determina el número de núcleos radiactivos en una muestra reciente y en otra antigua, puede calcularse la edad de la muestra antigua. El éxito de esta ingeniosa técnica depende de la exactitud con la que se pueda medir la velocidad de desintegración. Tres técnicas son las principales utilizadas en la actualidad para la medida del C-14 en cualquier muestra: recuento proporcional de gas, recuento de centelleo líquido y espectrometría de masas con aceleradores. La espectrometría es el método más moderno y, también, el considerado como más eficiente y fiable; precisamente esta técnica no tiene en cuenta las partículas beta, sino el número de átomos de carbono presentes en la muestra y la proporción en ella de sus tres isótopos (C-12, C-13 y C-14).
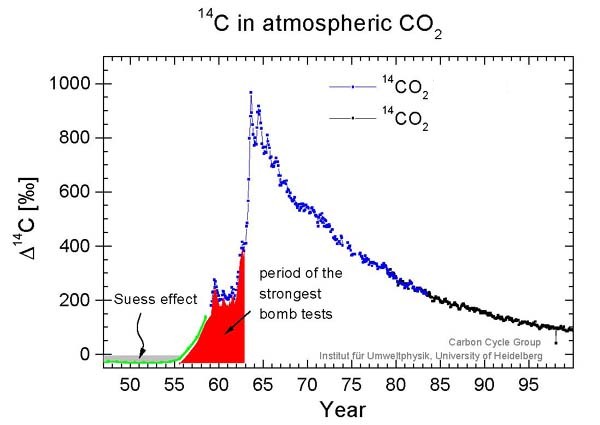
La precisión en la medida del radiocarbono en una muestra es tanto menor cuanto mayor es su antigüedad, debido a su menor contenido en el número de radionucleidos. Esta es la razón por la que esta técnica de datación no permite la medida, con un mínimo grado de fiabilidad, en muestras de más de 50 000 o 60 000 años. Por otro lado, y a pesar de que la cantidad de rayos cósmicos que llegan a la Tierra y, por tanto, la tasa de producción de C-14, que depende de factores como la actividad solar y el campo magnético terrestre, se ha mantenido prácticamente constante durante los últimos 60 000 años, sin embargo ha habido otros elementos en este tiempo, derivados de la actividad humana, que han conducido a oscilaciones en la cantidad de C-14 atmosférico. Dignos de mención en este sentido han resultado los ensayos con bombas atómicas durante las décadas de 1950 y 1960, que incrementaron la proporción de C-14 en la atmósfera; en los últimos años los valores por este factor vuelven a recuperar los de lo previos a las explosiones. Pero, por otra parte, también está documentada en la actualidad la influencia de la combustión del petróleo a lo largo del desarrollo de la era industrial, fenómeno conocido como efecto Suess, que ha incrementado la proporción de C-12 en la atmósfera. Ambos efectos se contrarrestan, por lo que la proporción C-14/C-12 en la atmósfera continúa manteniéndose prácticamente constante.
Una de las aplicaciones del uso de la técnica del carbono radiactivo fue la determinación de la edad del sudario de Turín (sábana hecha de lino, material orgánico). En 1988, tres laboratorios de Europa y Estados Unidos, que trabajaron con muestras de menos de 50 mg del sudario, demostraron, de forma independiente, que el sudario data de entre 1260 d.C. y 1390 d.C. Por tanto, el sudario no pudo haber sido la mortaja de Cristo. Algunas investigaciones posteriores dudan de estos resultados porque creen que esta muestra no reúne las condiciones óptimas para fechar su edad por este método de manera fiable: posibilidad de haber incorporado más C-14 debido a diferentes circunstancias a las que ha estado sometida, además de la posibilidad de la presencia de C-14 más moderno por una reparación del tejido realizada en época medieval. Sea como fuere, probablemente el futuro y, puede que esta u otras técnicas de datación, arroje un resultado más preciso y fiable que, definitivamente, constate la edad de la denominada Sábana Santa. En cualquier caso, y como siempre ha sido a lo largo del desarrollo del Método Científico, lo mejor de este tipo de conclusiones y de noticias es, comprobar una vez más, el carácter revisable de todos los hallazgos en Ciencia.