Valoración de un ácido poliprótico débil con una base fuerte
Una demostración que habitualmente se realiza en los laboratorios de los institutos de educación secundaria, especialmente dirigida a los alumnos de bachillerato, es la valoración ácido-base. En el momento de decidir la experiencia específica a realizar suelen considerarse criterios que incluyen desde los contenidos del currículo que se pretenden mostrar hasta la simplicidad y transparencia del experimento a ejecutar. Quizás sea precisamente por estos criterios por lo que con mayor frecuencia sea la valoración de un ácido monoprótico fuerte con una base, también fuerte, la que se aborde, bien como demostración efectuada por el profesor bien como experiencia a desarrollar por los estudiantes.
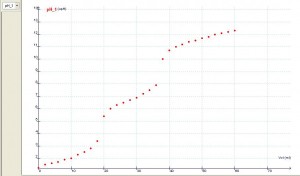
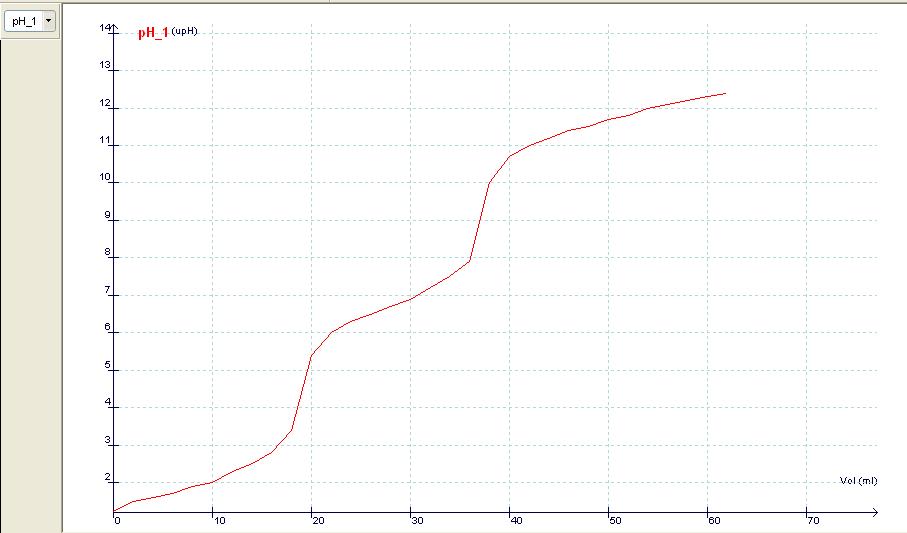
Las valoraciones de ácidos polipróticos raramente se realizan en los niveles mencionados; no cabe duda, sin embargo, del interés que alberga en esos casos la detección de los diferentes puntos de equivalencia así como de los puntos intermedios en los que puede comprobarse la presencia de las correspondientes disoluciones reguladoras. Si además se dispone de una consola de detección de datos que permita medir los valores del pH en función del volumen del reactivo valorante, se conseguirá, de ese modo, una fácil, rápida y muy visual manera de obtener la curva de valoración correspondiente.
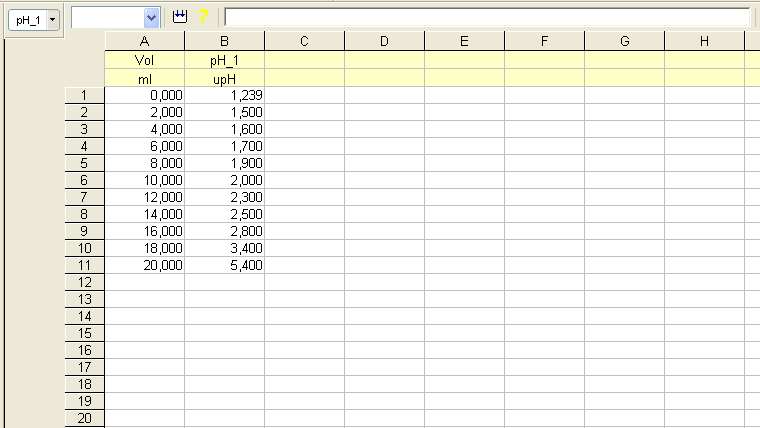
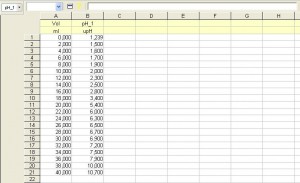
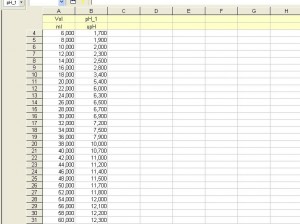
En lo que se expone a continuación se muestran los resultados de la valoración del ácido fosfórico, H3PO4, con el hidróxido de sodio, NaOH. Para la reacción ácido-base se han utilizado 20 mL de H3PO4 0,50 M, como reactivo a valorar; y NaOH 0,50 M, como reactivo valorante. Además, se ha utilizado indicador universal como indicador ácido-base y un pH-metro conectado a una consola de toma de datos.
Durante el transcurso de la reacción ácido-base se produce la disociación progresiva del ácido triprótico en sus tres protones y demás iones, los cuales alcanzarán concentraciones en el equilibrio que estarán de acuerdo con las correspondientes constantes:
H3PO4 + H2O = H2PO4– + H3O+ ; Ka1 = 7,1 . 10-3 ; pKa1= 2,2
H2PO4– + H2O = HPO42- + H3O+ ; Ka2 = 6,3 . 10-8 ; pKa2= 7,2
HPO42- + H2O = PO43- + H3O+ ; Ka3 = 4,2 . 10-13 ; pKa3= 12,4
Es importante destacar que las diferentes etapas de una neutralización únicamente se observan si las sucesivas constantes de disociación difieren significativamente de magnitud, por ejemplo en un factor de 103 o más, aspecto que se cumple sobradamente en el caso del ácido fosfórico. Si esta diferencia fuera menor, la segunda etapa de la valoración empezaría antes de que terminara la primera, y así sucesivamente.
De acuerdo con la estequiometría de la reacción ácido-base se necesitará un volumen de 20 mL de NaOH 0,50 M para alcanzar el primer punto de equivalencia; un volumen adicional de 20 mL para el segundo; y, por último, es de esperar que el tercer punto se consiga con otros 20 mL de NaOH 0,50 M, pero en este caso la detección es más difícil de apreciar por tratarse de un valor de pH próximo al de la base fuerte.
En lo que respecta a los puntos medios entre el momento inicial (VNaOH = 0) y el 1º P.E.; el 1º y 2º P.E.; y el 2º y 3º P.E., los valores de pH serán los correspondientes a las disoluciones reguladoras que se obtienen en esos momentos de la reacción; puede analizarse en estos puntos la concordancia de los resultados de la experiencia con los que nos dicta la teoría, considerando la ecuación de Henderson-Hasselbalch:
pH = pKa + log ( [base conjugada] / [ácido] ) (*)
El primero de los puntos medios antes aludidos sucede cuando VNaOH = 10 mL:
H3PO4 + H2O = H2PO4– + H3O+ ; Disolución reguladora H3PO4/ H2PO4–
[H3PO4 ] = [H2PO4– ] y, por tanto, de acuerdo con (*), pH= pKa1, pH = 2,2
Cuando VNaOH = 20 mL se alcanza el primer punto de equivalencia:
Ahora prácticamente todas las moléculas de H3PO4 se han convertido en su sal, NaH2PO4. El H2PO4– posee carácter anfótero, de modo que ha de considerarse el equilibrio de disociación como ácido y el de hidrólisis como base:
H2PO4– + H2O = HPO42- + H3O+ ; Ka2 = 6,3 . 10-8
H2PO4– + H2O = H3PO4 + OH– ; Kb = Kw/Ka1 = 1,4 . 10-12
Esta disolución es ácida porque Ka2 es mayor que Kb para el H2PO4–, es decir, la reacción que produce H3O+ predomina sobre la que produce OH–. El valor del pH considerando los equilibrios anteriores se calcula así:
pH = 1/2 (pKa1 + pKa2) ; pH = 4,7
El punto medio entre el 1º y 2º P.E. se consigue cuando VNaOH = 30 mL:
H2PO4– + H2O = HPO42- + H3O+ ; Disolución reguladora H2PO4–/ HPO42-
[H2PO4– ] = [ HPO42-] y, por tanto, de acuerdo con (*), pH= pKa2, pH = 7,2
Cuando se alcanza el segundo punto de equivalencia, VNaOH = 40 mL:
Ahora prácticamente todas las moléculas de NaH2PO4 se han convertido en Na2HPO4. El HPO42- es otro ion que posee carácter anfótero, de modo que ha de considerarse el equilibrio de disociación como ácido y el de hidrólisis como base:
HPO42- + H2O = PO43- + H3O+ ; Ka3 = 4,2 . 10-13
HPO42- + H2O = H2PO4– + OH– ; Kb = Kw/Ka2 = 1,6 . 10-7
Esta disolución es moderadamente básica porque Kb es pequeña pero de mayor valor que Ka3 para el HPO42-, es decir, la reacción que produce OH– predomina sobre la que produce H3O+. El valor del pH considerando los equilibrios anteriores se calcula así:
pH = 1/2 (pKa2 + pKa3) ; pH = 9,8
En lo que respecta al punto medio entre el 2º y 3º P.E., se alcanza cuando VNaOH = 50 mL:
HPO42- + H2O = PO43- + H3O+ ; Disolución reguladora HPO42-/ PO43-
[HPO42-] = [PO43-] y, por tanto, de acuerdo con (*), pH = pKa3, pH = 12,4
Cuando VNaOH = 60 mL se entiende que se alcanza el tercer punto de equivalencia aunque, como ya se indicó antes, este punto es más difícil de detectar:
Ahora todas las moléculas de Na2HPO4 se han convertido en su sal, Na3PO4. El ion PO43- sufre el proceso de hidrólisis:
PO43- + H2O = HPO42- + OH– ; Kb = Kw/Ka3 = 2,4 . 10-2
Esta disolución es muy básica; concretamente, teniendo en cuenta el equilibrio anterior, se obtiene un valor aproximado para el pH de 13, valor que se aproxima a la de la disolución de la base fuerte empleada en la valoración.
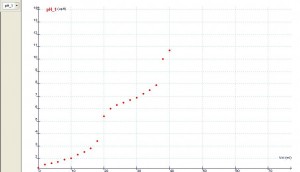
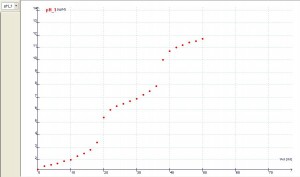
Si analizamos los resultados de la experiencia, podemos concluir que existe una concordancia razonablemente aceptable entre los valores calculados y los medidos durante la reacción ácido-base que se muestran en las tablas y gráficas.
La curva de valoración ácido-base que finalmente resulta es:
Los colores respectivos que adopta el indicador universal en los seis momentos de la valoración descritos se muestran en la siguiente imagen:
Respecto a los indicadores óptimos para esta neutralización, otro procedimiento consistiría en la utilización de dos indicadores que pongan de manifiesto el 1º y el 2º P.E. respectivamente; por ejemplo, naranja de metilo y fenolftaleína. El pH en el primer P.E. se encuentra aproximadamente dentro del intervalo en el que el indicador naranja de metilo cambiaría de color rojo a naranja (pH entre 3,1 y 4,4). La fenolftaleína es un indicador adecuado para el segundo P.E.; su cambio de color se produciría de incoloro a rosa pálido (pH entre 8,2 y 10,0).
Comentar, antes de terminar, que la valoración del ácido fosfórico es de especial interés, no únicamente por tratarse de un ácido poliprótico adecuado para la detección de los sucesivos puntos de equivalencia sino, además, por funcionar como un electrolito que actúa como tampón biológico amortiguando el efecto de ácidos en el interior de nuestras células y en los huesos, debido a la elevada cantidad de fosfato en estos medios. Concretamente es la disolución reguladora H2PO4–/HPO42-, que se forma entre el 1º y 2º P.E., la que realiza el efecto de tamponar ya que su pH es el más cercano al valor del pH fisiológico, aunque la relación en las concentraciones de ambos iones no corresponde, en ese caso, a la del punto medio entre los primeros P.E. analizado en la experiencia aquí mostrada, sino que la de la base conjugada es cuatro veces la del ácido.