De la pila de Bagdad al coche de hidrógeno (I)
La ciencia moderna establece el año 1800 como el punto de partida de los grandes avances científicos y tecnológicos que se desarrollaron a partir del primer generador de electricidad obtenido por Alessandro Volta en ese año. Pero como otras veces ha sucedido, la arqueología aporta datos que nos hacen pensar que los generadores de electricidad se conocían desde mucho antes; una vez más, la modernidad llegó con retraso.
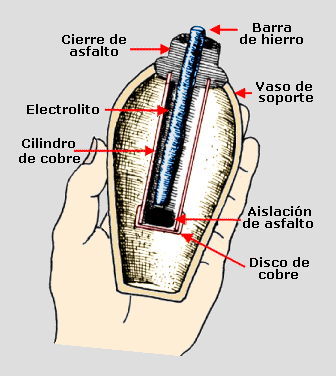
En el año 1938, un arqueólogo austriaco, de nombre Wilhelm Konig, investigando un material almacenado en el museo de Bagdad, encontró una pequeña pieza de arcilla de unos 15 cm de alto y cuya antigüedad se estimó en unos 2 000 años. La pieza era un pequeño recipiente en cuyo interior había un cilindro de cobre de unos 12 cm, hecho con una lámina de este material soldada con una mezcla de estaño-plomo (60/40), similar a las que se usan hoy en día. El cilindro tenía en su extremo inferior una tapa de cobre sellada con asfalto y, en el otro extremo, otra tapa de asfalto de la que salía una barra de hierro que se alojaba en el eje central del cilindro; esta barra de hierro estaba corroída, como si hubiese sido atacada por un ácido. Konig se dio cuenta de que estaba ante lo que podría ser una pila eléctrica de la Antigüedad que habría usado como electrolito zumo de uva, vinagre u otro ácido similar.
Otras excavaciones realizadas en el sur de Irak sacaron a la luz vasos de cobre recubiertos por una delgada capa de plata que fueron fechados unos 500 años a.C. Este proceso de plateado electrolítico o galvanostegia requiere de un generador de corriente continua de suficiente potencial, lo que nos demuestra que ya en esta época, no solo se conocía la existencia de pilas, sino que se asociaban en serie para obtener la energía suficiente.
Pero no es este el único lugar del mundo donde se encontraron vestigios de generadores eléctricos primitivos. Restos arqueológicos procedentes del antiguo Egipto incluyen objetos que debieron haber sido plateados de forma electrolítica, y en la tumba del general chino Chu (265-316 d.C.) se encontró un cinto hecho con una aleación que contiene un 85 % de aluminio. Este metal solo se puede obtener por electrolisis de la bauxita, un mineral de óxido de aluminio, y requiere un generador de un gran potencial; sin embargo, el procedimiento industrial que se utiliza actualmente para su obtención se patentó en el siglo XIX e hizo millonario a su inventor, el estadounidense Charles Martin Hall.
El porqué descubrimientos que hoy tienen gran importancia social estuvieron ocultos a la humanidad durante tanto tiempo es una pregunta que no tienen fácil respuesta. Muy probablemente la arqueología continuará desvelándonos secretos tanto o más sorprendentes que la pila de Bagdad y redescubriremos cosas que para nuestros ancestros era algo cotidiano.
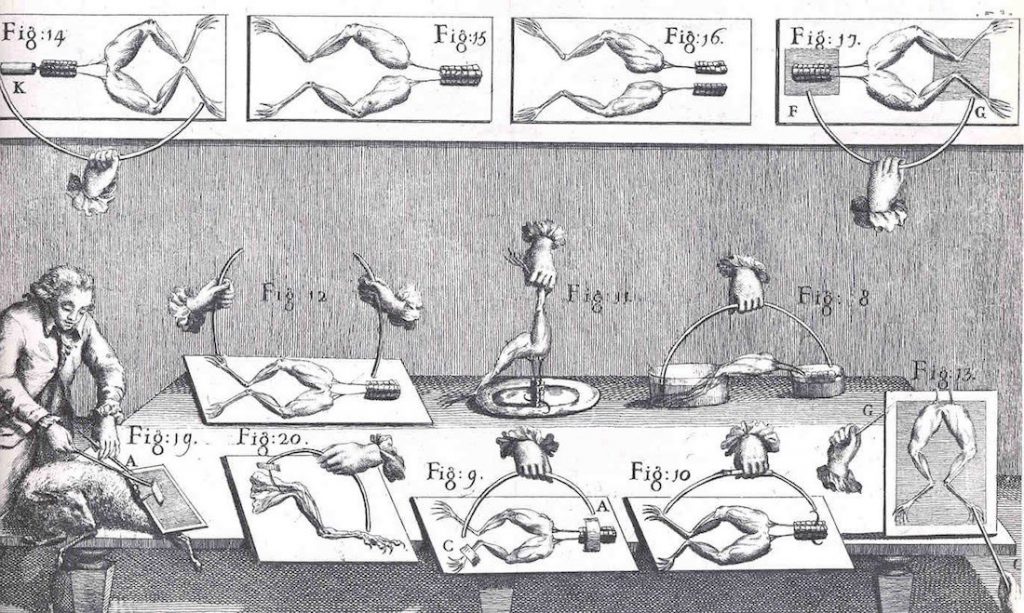
Ya en la Edad Moderna, concretamente en 1786, el fisiólogo italiano Luigi Galvani (1737-1798), observó que una pata de rana diseccionada se contraía cuando se la colocaba sobre una mesa cerca de un generador electrostático (una observación similar había sido hecha realmente treinta años antes por Floriano Caldani). Galvani completó su observación creyendo haber descubierto lo que él llamaba “electricidad animal”: colgó una pata de rana de una barandilla de hierro por un gancho de latón y notó que la parte inferior de la pata se contraía cuando entraba en contacto con la otra parte de la barandilla. Los informes de Galvani despertaron el interés de otro científico italiano, el químico y físico italiano Alessandro Volta antes mencionado. Volta pensó que la pata de rana colgada de la barandilla del balcón no se contraía por la electricidad del animal, sino debida a la diferencia de potencial entre dos metales distintos (el latón del gancho, que es cobre principalmente, y el hierro de la barandilla), los cuales se interconectaban a través del tejido animal. Para Volta los nervios y músculos de la rana representaban un electroscopio extremadamente sensible, de tal forma que permitía la detección de una corriente mucho más débil que la que se había estudiado con cualquiera de los aparatos disponibles en aquellos tiempos.
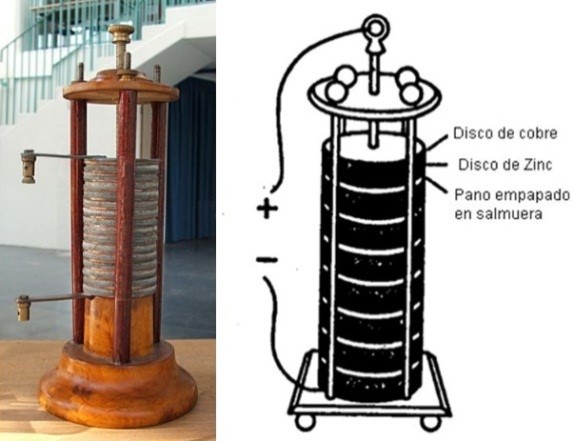
Volta probó su teoría de los diferentes potenciales eléctricos en metales distintos con la invención de la primera batería práctica, la cual describe en una carta a la Royal Society de Londres en 1800. Consiguió generar la primera fuente de corriente eléctrica útil merced a la química involucrada en el proceso redox que se establecía entre dos metales distintos puestos en contacto a través de una disolución salina. Se trataba del primer generador de electricidad, denominado batería por su creador y que hoy se llama pila. Previamente solo se conocían los generadores electrostáticos, los cuales producían descargas de alto voltaje, pero no podían dar una corriente continua. Incluso en sus comienzos, la batería de Volta hizo posible algunos hitos electroquímicos importantes tales como el descubrimiento de Humphry Davy de los metales sodio y potasio entre otros.
En la última década del siglo XIX, el físico estadounidense de origen croata Nikola Tesla patentó un motor de corriente alterna y un generador, lo que permitió establecer un sistema eléctrico similar al actual. Gracias a él se dispuso de energía eléctrica en cantidad suficiente para el desarrollo industrial que hemos alcanzado. Así fue posible, por fin, generalizar el uso de la electricidad.
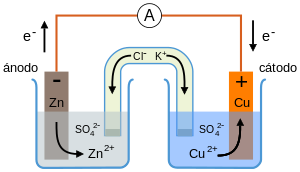
La química siguió y sigue buscando procesos redox alternativos con los que obtener pilas más eficaces, duraderas y de menor tamaño. Así tenemos ya la pila seca convencional (pila de Volta y pila de Leclanché), la pila húmeda (pila de Daniell), las alcalinas, las de botón, las recargables, las de flujo…En cualquier caso es importante aclarar que ninguna es mejor que otra sino que se seleccionan para una aplicación en particular teniendo en cuenta aspectos como su masa, costo, confiabilidad y capacidad.
Sea como fuere debemos referirnos a las pilas también como dispositivos transformadores de energía puesto que la base de su funcionamiento es, siempre, la conversión de energía química en energía eléctrica.
Las baterías de ion litio y el Nobel
Las baterías de ion litio son un tipo de batería recargable muy usadas actualmente en los aparatos electrónicos. En las baterías recargables (baterías o celdas secundarias) las reacciones de oxidación y reducción son reversibles, pueden fluir en ambas direcciones. Es decir, la reacción de la celda puede invertirse haciendo pasar electricidad a través de ella (cargándola). Esto significa que la batería puede utilizarse durante varios cientos o más ciclos de descarga seguida de carga.
Bastante tiempo antes de la creación de las baterías de litio ya se pensaba en la utilización de este metal debido a la facilidad con que se desprende de su electrón más externo; de hecho, se trata del elemento químico con menor potencial de reducción. Cuando pierde su electrón se transforma en ion litio (Li+), razón por la que estas baterías también se denominan de ion litio. El ion litio se mueve entre los electrodos negativo (ánodo) y positivo (cátodo). Pero la historia y evolución de estas baterías ha sido larga y difícil debido, precisamente, a su extrema facilidad para ceder un electrón a cualquier otra sustancia química.
El boom en la carrera investigadora de las baterías de litio se desató en la década de 1970 originado por la crisis del petróleo. Parecía claro, en el mundo de las baterías, que la solución residía en utilizar un ánodo de litio. Faltaba descubrir el cátodo perfecto. La primera tenía un cátodo de sulfuro de litio y titanio, un ánodo de litio metálico puro y el electrolito era LiPF6 disuelto en carbonato de propileno. Así se lograban 2,5 V. La primera batería de litio comercial fue una evolución de esta, desarrollada por la empresa Exxon, pero se encontraron con un problema: cuando estas baterías se sobrecalentaban, llegaban a explotar. Descubrieron que lo que ocurría es que tras cada ciclo de carga y descarga se iban formando dendritas de litio que traspasaban la barrera del electrolito hasta llegar al cátodo, produciendo así un cortocircuito. El problema parecía resolverse usando un ánodo diferente, un ánodo que pudiese acomodar al litio de forma más estable y segura. La respuesta la encontraron en 1985: el coque de petróleo, un sólido carbonoso derivado del refinado del petróleo (se parece al grafito) que era capaz de alojar al litio de forma muy eficiente.
En 1991 las empresas Sony y Asahi Kasei sacaron a la venta la primera batería de ion litio comercial similar a las actuales: ánodo de coque y cátodo de óxido de cobalto(III) y litio, LiCoO2. Ambos electrodos poseen una disposición laminar en la que pueden acomodar al litio. Durante el funcionamiento de la batería, es decir, en el ciclo de descarga, el ion litio viaja del ánodo al cátodo a través del electrolito; los electrones de los que se desprenden los átomos de litio viajan en el mismo sentido pero a través de un circuito externo, alimentando así cualquier aparato electrónico. La diferencia en los potenciales electroquímicos de los electrodos es la causa de que la batería aporte energía al aparato al que esté conectada. En el ciclo de carga, al conectar la batería a una fuente de energía externa, los iones de litio hacen el viaje en sentido contrario. El hecho de que los iones de litio entren y salgan ordenadamente en el ánodo y en el cátodo garantiza que estas baterías apenas tengan “efecto memoria”, es decir, que puedan cargarse sin esperar a que se hayan descargado completamente ya que su capacidad apenas se ve disminuida. En la actualidad el uso de polímeros conductores como electrolito ha dado lugar a un nuevo tipo de baterías de ion litio y polímero. Las investigaciones en este campo están produciendo baterías con cátodos más eficientes, más baratas, de mayor duración y con posibilidad de soportar un mayor número de ciclos de carga y descarga. También hay expertos que aseguran que el futuro está en el uso del litio y el grafeno.
En 2019 el desarrollo de las baterías de ion litio logró el Premio Nobel de Química repartido a partes iguales entre el alemán John B. Goodenough, el británico M. Stanley Whittingham y el japonés Akira Yoshino. Whittingham fue quien lideró la investigación en la intercalación de iones de Li en sulfuros doblemente metálicos en los años 70. Goodenough, que trabajó para Exxon, fue quien en los años 80 propuso la solución al problema del sobrecalentamiento utilizando el cátodo de óxido de cobalto y litio. Yoshino, que trabajaba para Asahi Kasei, propuso en 1985 el ánodo de coque.
Además de lo relativo al “efecto memoria” antes mencionado, varias son las ventajas que presentan este tipo de baterías. No contienen metales pesados, por lo que son mucho menos contaminantes. Además, al no tener agua en su composición, pueden operar a temperaturas muy bajas (-50 ºC). Proporcionan una densidad de energía de, al menos, 120 Wh/kg y un voltaje mayor de 4,2 V. Estos valores son apreciablemente mayores que los que ofrecen otros tipos de pilas; por ejemplo, las baterías de plomo-ácido, utilizadas en los automóviles desde aproximadamente 1915, ofrecen 30 Wh/kg y 2 V, razón por la que deben disponerse series de 6 para producir los habituales 12 V. Estas razones explican, entre otros aspectos, que las baterías de litio sean tan compactas y que muchos aparatos electrónicos, como los teléfonos móviles, se hayan aligerado tanto.