La belleza de la quimioluminiscencia
Si te preguntaran cuáles son algunos de los fenómenos más bellos que puedes contemplar en el laboratorio de química, ¿qué responderías? Yo no dudaría: las reacciones químicas luminiscentes.
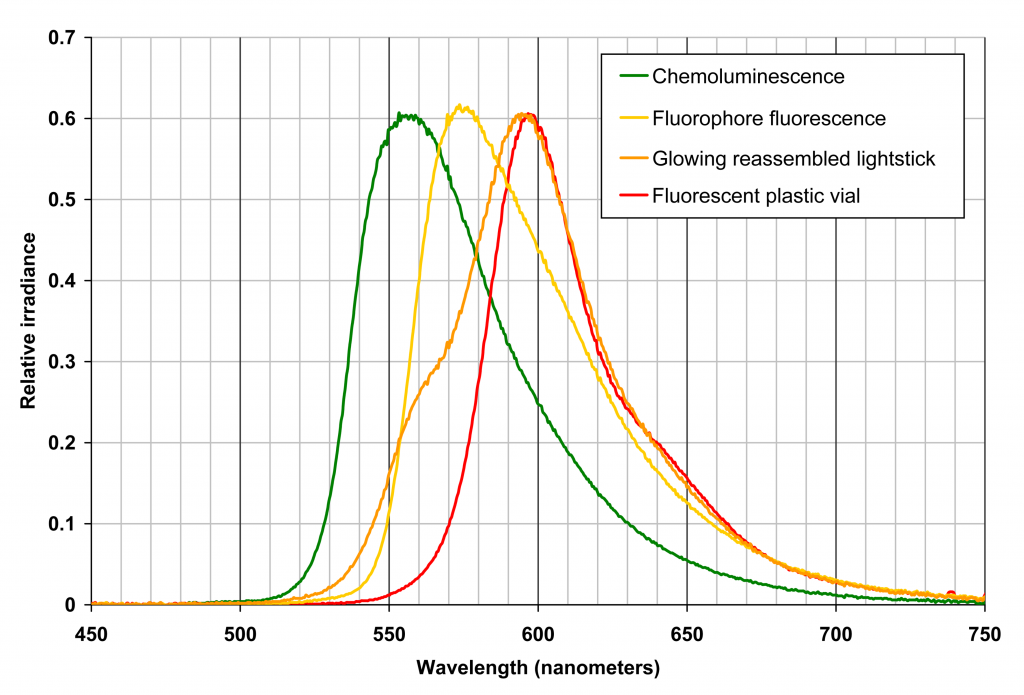
Los fenómenos quimioluminiscentes engloban una serie de procesos químicos exotérmicos en los que la energía desprendida se emite en forma de luz (luminiscencia), además de en forma química y térmica. Todas las sustancias a temperatura superior a la ambiente emiten energía en forma de radiación electromagnética infrarroja, pero la quimioluminiscencia se produce cuando la radiación emitida pertenece al rango del visible y/o ultravioleta, ya que las reacciones químicas de oxidación-reducción, involucradas en la inmensa mayoría de los fenómenos quimioluminiscentes, dan lugar a la emisión de ese tipo de radiación. La reacción química sucede de modo que los reactivos se transforman en sustancias que se encuentran en un estado electrónico excitado (singlete o triplete, de acuerdo con la mecánica cuántica); este estado decae a un estado electrónico correspondiente al fundamental o de mínima energía, liberándose la diferencia de energía entre ambos en forma de un fotón de luz. Este fenómeno recibe también la denominación de “emisión de luz fría”, debido a que la energía luminosa se produce sin calentamiento previo. Una forma específica de quimioluminiscencia la constituye la bioluminiscencia, que consiste en la emisión de luz por un organismo vivo, merced a la reacción química de oxidación que el compuesto denominado luciferina sufre por la acción de una enzima; el ejemplo más conocido es el de la luz emitida por las luciérnagas, pero el fenómeno se encuentra ampliamente distribuido en diferentes grupos animales, especialmente en ambientes marinos. Otros fenómenos luminiscentes son los fluorescentes y los fosforescentes. Sin embargo, en estos casos la diferencia con los quimioluminiscentes es manifiesta ya que la emisión de luz se produce por la absorción previa de radiación electromagnética por parte de alguna sustancia; absorción que la conduce al estado electrónico excitado sin estar involucrado ningún cambio químico. Las sustancias fluorescentes dejan de emitir luz (“brillar”) casi inmediatamente después (entre 10-9 y 10-6 s) de la detención de la fuente de radiación electromagnética; sin embargo, las fosforescentes continúan emitiendo luz durante un tiempo después (entre 10-3 s y varios minutos).
En otras ocasiones lo que podemos ver es la producción de una reacción química con emisión de luz, merced a la energía que absorben los reactivos; en este caso tendremos un proceso fotoquímico, que es la antítesis del quimioluminiscente. Existen muchos procesos fotoquímicos: uno de ellos lo constituye la oxidación del magnesio previo calentamiento, por citar uno ampliamente conocido.
La quimioluminiscencia tiene muchas y variadas aplicaciones, principalmente en los campos de la química y de la biología: química ambiental, química analítica, bioquímica… También ha manifestado su utilidad en la investigación biomédica, por ejemplo, en el estudio de la eficacia de algunos medicamentos para combatir el cáncer.
El primer compuesto quimioluminiscente sintetizado en laboratorio fue el 2,4,5-trifenilimidazol (lofina). Bronislaw Radziszewski, químico polaco, profesor y rector de la Universidad de Lviv, autor de trabajos de cierta relevancia en el campo de la química orgánica, fue quien lo consiguió en 1877. Se comprobó que emitía luz de color amarillo verdoso al sufrir oxidación en presencia de hidróxido de potasio y disolución acuosa de etanol. Se trata éste de un ejemplo de quimioluminiscencia en fase líquida. Si el medio es acuoso el fenómeno luminiscente es causado principalmente por reacciones redox, como es también el caso del luminol, sólido cristalino amarillento que, en solución alcalina, junto con peróxido de hidrógeno (o algún otro oxidante) y hierro o cobre como catalizadores, produce quimioluminiscencia. Esta reacción es muy popular porque se utiliza en investigación forense para detectar trazas de sangre: en presencia de un agente oxidante, el luminol reacciona merced al hierro presente en la hemoglobina produciendo la emisión de una luz azul, visible en un lugar oscuro. El brillo dura unos 30 segundos y puede quedar manifiesto en fotografías de larga exposición. En cualquier caso, la intensidad del brillo no es representativa de la cantidad de sangre en la muestra que se analiza sino de la distribución de las trazas en la misma; por esta razón es importante que el análisis se lleve a cabo mediante la aplicación uniforme del luminol, evitando así resultados engañosos, ya que las trazas de sangre parecerán más concentradas en las zonas donde se aplique más cantidad del reactivo indicado.
En nuestro Departamento los estudiantes han conseguido la quimioluminiscencia del luminol en varias demostraciones en el laboratorio:
Los “lightsticks” (tubos luminosos) constituyen un sistema quimioluminiscente, también en fase líquida, disponible comercialmente, de color verde amarillento fácilmente visible en una habitación a oscuras o poco iluminada. La luz emitida, inicialmente lo suficientemente brillante incluso para hacer posible la lectura, se desvanece gradualmente durante un período de aproximadamente 12 horas. En el caso de la marca comercial “CYALUME”, estos objetos quimioluminiscentes consisten en una disolución de peróxido de hidrógeno contenida en una ampolla de vidrio, rodeada ésta por otra disolución acuosa de un éster y un colorante fluorescente. Tras la agitación del tubo y consiguiente rotura de la ampolla, el peróxido de hidrógeno y el éster entran en contacto, dando así inicio al proceso quimioluminiscente. Durante el curso de la reacción, el intermedio energéticamente excitado que se produce transfiere energía a la molécula de colorante produciéndose, de este modo, también el fenómeno fluorescente.
El fenómeno quimioluminiscente también se produce en las fases sólida y gaseosa.
En lo concerniente a la fase gaseosa, probablemente el más conocido sea el correspondiente a la oxidación del fósforo blanco que, por otra parte, es la más importante de las reacciones que sufre el fósforo elemental. Pueden producirse dos diferentes procesos de oxidación. Si ocurre una oxidación rápida, se origina un proceso exotérmico que se manifiesta con una llama amarilla y calor más que suficiente para quemar los materiales combustibles cercanos. Pero si la oxidación es lenta se origina un fenómeno quimioluminiscente: ocurre cuando el vapor de fósforo en las inmediaciones del sólido, procedente de la sublimación de éste, reacciona con el aire y emite un brillo verdoso.
Otro ejemplo bastante popular de fenómeno quimioluminiscente en fase gaseosa es el que se produce por la reacción química entre el “óxido nítrico” (NO) y/o “óxido nitroso” (N2O) y el disulfuro de carbono (CS2). En este caso, cuando se produce la ignición de una mezcla de cualquiera de los óxidos de nitrógeno gaseosos citados y del vapor de disulfuro de carbono, encendiendo la mezcla en la parte alta de un tubo largo y transparente, se produce una llama que viaja a gran velocidad hasta el extremo inferior del tubo, pudiéndose observar la luz azul brillante emitida así como escuchar un fuerte ruido similar, de algún modo, al ladrido de un perro. Esto último ha motivado que se haga referencia a la reacción con la denominación “Barking Dog”. De acuerdo con Bassam Z. Shakhashiri (profesor de química en la Universidad de Wisconsin-Madison y autor de varios libros de demostraciones químicas), la ecuación química (sin ajustar), en el caso de que sea el NO el óxido de nitrógeno involucrado en la reacción, puede resumirse así:
NO(g) + CS2(g) = N2(g) + CO(g) + CO2(g) + SO2(g) + S8(s) y, dependiendo de las condiciones de reacción, también pueden encontrarse entre los productos trazas de COS y N2O. La estequiometría de la reacción es bastante compleja y depende de las concentraciones de los reactivos. Tanto en el caso del óxido nítrico como en el del óxido nitroso, los productos comunes que se obtienen son: azufre elemental (S8), que forma un depósito amarillo en el interior del tubo; dióxido de azufre (SO2), cuyo olor puede ser detectado después de la reacción; dióxido de carbono (CO2) y nitrógeno (N2). El dióxido de azufre se produce en un estado energéticamente excitado (“triplete”), liberando el exceso de energía en forma de luz.
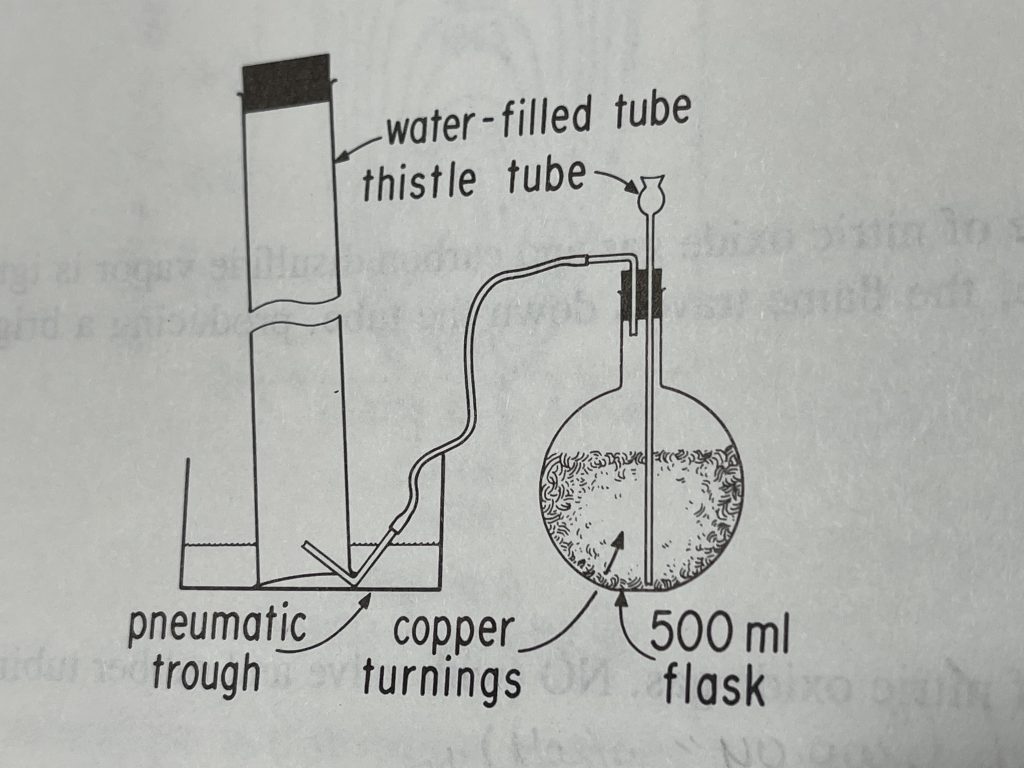
Para reproducir esta experiencia es necesario disponer de botellas de óxido nitroso o nítrico, gases que no se encuentran habitualmente en los laboratorios de los centros educativos o, al menos, no en los de educación secundaria. Un procedimiento para conseguir cualquiera de ellos lo constituye la reacción química entre el ácido nítrico y el cobre. El método operativo se resume en la imagen y vídeo siguientes. Ha de tenerse en cuenta que el óxido que se consigue en un primer momento es el dióxido de nitrógeno, NO2, de color pardo-rojizo, debido a la oxidación, en presencia del aire en el interior del matraz de reacción, de los óxidos nitroso o nítrico. Por esta razón es muy importante no recoger el gas desprendido, dentro del matraz, en el interior del tubo colector hasta transcurridos 1 o 2 minutos, pasados los cuales es previsible el consumo del oxígeno del matraz; esto se comprueba por la ausencia del color antes mencionado, ya que los óxidos nitroso y nítrico son incoloros.
La mayor intensidad de luz azul emitida durante la reacción corresponde a radiación electromagnética del rango del visible, principalmente, con longitud de onda comprendida en el intervalo entre 310 y 490 nm.
Para justificar lo concerniente al fuerte sonido emitido hay que considerar que la reacción química oscila a lo largo del tubo. Las oscilaciones se producen porque, a pesar de la importante liberación de energía en forma de luz, la mayoría es en forma de calor. Este calor aumenta la temperatura de los productos gaseosos produciendo su expansión y la consiguiente tendencia a escapar del tubo, disminuyendo de este modo la presión en su interior. Al tratarse de una reacción en fase gaseosa, la presión influye (de acuerdo con las observaciones de manera notable en este caso concreto) sobre la velocidad, de modo que la disminución en la primera origina también la de la segunda. Al ralentizarse la reacción la presión se reduce aún más, y ello deriva en que los gases se precipitan hacia el área de baja presión, volviendo esta magnitud a incrementarse y, con ella, la velocidad de reacción y la tasa de liberación de energía. De este modo comienza un nuevo ciclo (oscilación). Los cambios en la presión de los gases en el tubo producen vibraciones (cambios en la presión) del aire de la habitación, originando así un fuerte ruido. Los aumentos y disminuciones en la presión de los gases se ven magnificados por los cambios en la velocidad de la reacción; de este modo las vibraciones del aire circundante son cada vez más fuertes.
Fue el químico alemán Justus von Liebig, pionero en el estudio de la química orgánica, quien descubrió esta reacción y quien, en abril de 1853, realizó la demostración correspondiente a “Barking Dog” frente a la familia real bávara. La demostración fue recibida y aplaudida con tanto entusiasmo, que se convenció a Liebig para que repitiera el experimento, pero durante la segunda ejecución se produjo un accidente debido a que el recipiente de vidrio utilizado para la reacción estalló y los fragmentos que salieron despedidos produjeron algunas heridas leves en los rostros de la reina Teresa, su hijo, el príncipe Luitpold, y el propio Liebig. Algunos investigadores creen que la rotura del recipiente pudo deberse, bien a la escasa resistencia del vidrio utilizado frente a las variaciones en la presión de los gases, bien a la producción de una explosión violenta debido a la combustión de posible dióxido de nitrógeno formado durante la reacción, bien a ambas circunstancias simultáneamente. Cuentan los historiadores de la ciencia que, en un noble gesto, la reina Teresa envió a su médico personal a atender a von Liebig la noche del suceso. También, el rey Ludwig lo visitó al día siguiente para comprobar su progreso y tranquilizarle por las consecuencias, al fin y al cabo leves, por el penoso suceso.