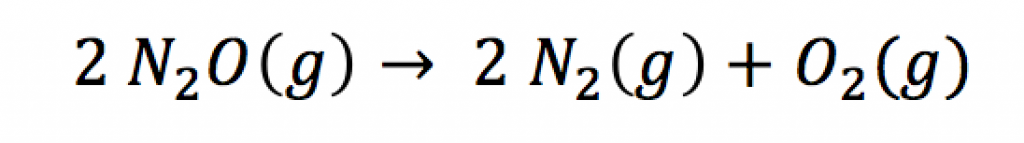El óxido nitroso: ¿gas para reír?
Recientemente los medios de comunicación han vuelto a hacerse eco del consumo desmedido, además de ilegal, del denominado gas de la risa (o gas hilarante) en algunos países europeos, como Reino Unido y también España. Noticias como esta pueden conducir a reflexiones varias. Una de ellas es que aquello que en los primeros años del siglo XIX fue usado por la gente joven como un gas de la risa, ahora, en el siglo XXI, los adolescentes modernos han aprendido que pueden “colocarse” con él. Otra, el hecho de que el uso de este gas condujera, en su día, al descubrimiento de la anestesia. Si se contrastan ambas, se concluye, como ha sucedido en muchas otras ocasiones en lo que al ámbito científico se refiere, el doble filo de esta sustancia: la peligrosidad que supone el uso indebido o los beneficios que aporta si ese uso es supervisado por manos expertas, como las de los profesionales médicos.
Sea como fuere hay que decir que pocos descubrimientos ha habido más serendípicos que los asociados a la anestesia con óxido nitroso (óxido de nitrógeno(I), N2O) y, coincidiendo en el tiempo, también con éter (dietiléter, (C2H5)2O); pocos tan importantes para la humanidad; y quizá ningún otro en que la paternidad y el honor hayan sido tan difíciles de asignar.
El óxido nitroso fue descubierto y sintetizado por el científico británico Joseph Priestley, mediante calentamiento del sólido nitrato de amonio a 270 ºC; Humphry Davy, químico, también de nacionalidad británica, sugirió su posible utilidad en las operaciones quirúrgicas; y, finalmente, el dentista estadounidense Horace Wells fue pionero en su uso como anestésico en las extracciones dentarias.
Quizás resulte conveniente, además de curioso, relatar algunos de los aspectos y acontecimientos relativos a este gas que la historia de la serendipia nos ha dejado, comenzando por el principio, es decir, por el momento de su descubrimiento y examen, lo cual se debe a Joseph Priestley, como antes quedó indicado, y a su “aparato neumático” en 1772, antes, incluso, de que el mismo Priestley dedujera la importancia para los seres vivos del entonces recientemente descubierto gas oxígeno. Volviendo al óxido nitroso le pareció que este gas no era tóxico, pero comprobó que producía unos efectos peculiares cuando era inhalado ya que las personas se veían alteradas, cantaban, peleaban o reían.
Más tarde, en 1798, Humphry Davy junto con el doctor Thomas Beddoes investigaron la utilización médica de varios gases en el Instituto Neumático fundado por el segundo en Bristol, Inglaterra. Davy enseguida descubrió que una inhalación prolongada del óxido nitroso producía una inconsciencia temporal. Probó el gas consigo mismo y, tras unas primeras pruebas, informó de que inhaló 18 litros (se entiende en condiciones ambientales) del gas durante siete minutos llegando a estar, de acuerdo con sus palabras, “absolutamente intoxicado”. Humphry Davy pensó que podría ser útil para un malestar corporal inducido por uno mismo: las resacas. Su cuaderno de laboratorio indica que las primeras pruebas fueron positivas y el malestar tras el consumo excesivo de alcohol disminuía tras la inhalación del gas.
El extravagante relato de muchas de las experiencias de Davy atrajo la atención sobre su persona, lo cual le condujo a ocupar una plaza en la Royal Institution londinense en 1801. Allí su ascenso y popularidad llegaron a ser espectaculares, además de descubrir a un genio como Michael Faraday, por aquel entonces un joven que le servía como asistente.
A pesar de los experimentos y descubrimientos de Davy relativos a los efectos del óxido nitroso y, por tanto, a sus posibles aplicaciones, en los primeros años del siglo XIX el único uso de este gas era como fuente de entretenimiento. Pero, unos cuantos años más tarde, en 1844, en la población de Hartford, en Connecticut (EE.UU.), se realizó una demostración pública con el gas utilizado como atracción y ocurrió un accidente que llevó al descubrimiento de la anestesia en las operaciones quirúrgicas.
El demostrador, un hombre llamado Colton, pidió voluntarios para inhalar el gas; unos cuantos lo hicieron y entre ellos estaba el joven llamado Samuel Cooley, que había venido con su amigo Horace Wells, el dentista antes citado. Después de inhalar el gas, Cooley se puso violento; se peleó con los otros, tropezó y se cayó. Tras recuperarse del golpe alguien de la audiencia observó un charco de sangre bajo su asiento y se comprobó que procedía de un corte profundo en su pierna. ¿Qué había sucedido? Cooley no se había dado cuenta y no sintió dolor hasta que los efectos del gas desaparecieron algún tiempo después. Pero su amigo, Horace Wells, se dio cuenta del significado de este suceso y, puesto que la extracción de dientes era muy dolorosa en aquellos días, especuló con la idea de que si el gas podía hacer a una persona tan insensible como para ignorar una gran herida como la que Cooley tenía, podría permitir la extracción indolora de los dientes. A Wells le faltó tiempo para comprobar en su persona el efecto de la inhalación del gas al hacerse extraer una muela. Los testigos entonces presentes manifestaron que se había mantenido inconsciente y no había experimentado dolor.
Más tarde, Wells efectuó una demostración en el anfiteatro del Hospital General de Massachusetts, en Boston. Un paciente se prestó a sufrir la extracción de un diente una vez inhalado el gas y estando bajo su influencia. Al parecer, se dio la circunstancia de que Wells se precipitó y dio la orden para efectuar la extracción antes de que la anestesia hubiese hecho todo el efecto, lo que produjo que el paciente lanzase gritos de dolor. Wells fue entonces abucheado de manera vergonzante en el anfiteatro, cayó en desgracia y pronto tuvo que abandonar su profesión.
Dos años después, en 1846, un estudiante, más tarde socio de Wells, William T.G. Morton, decidió probar el óxido nitroso en sus pacientes, ya que era conocedor de que Wells lo había usado posteriormente a la demostración fallida, habiendo conseguido resultados completamente satisfactorios. Morton preguntó (al menos es lo que él declaró) al entonces socio de Wells, Charles T. Jackson, cómo obtener el gas y éste le respondió que era preferible que utilizara éter (dietiléter) en su lugar ya que manifestó haber experimentado personalmente sus propiedades anestésicas tiempo atrás. Jackson explicó respecto al éter que, tras una larga búsqueda, había encontrado el procedimiento para que los nervios sensitivos se volvieran temporalmente insensibles permitiendo la ejecución de operaciones quirúrgicas sin que el paciente sufriera el consiguiente dolor. Siguiendo el consejo de Jackson, Morton comenzó a utilizar asiduamente dietiléter como anestésico en diferentes operaciones quirúrgicas; esto hizo que alcanzara buena fama.
Finalmente todas estas circunstancias fueron motivo de una gran controversia entre Wells, Morton y Jackson por la disputa en el descubrimiento de la anestesia. Además, un cuatro personaje entró en juego en esta contienda: el doctor Crawford W. Long, de Georgia. Al parecer, Long había comenzado a administrar éter en 1842 para extirpar unos tumores en la garganta de un paciente y continuó usándolo regularmente como anestésico, aunque no publicó su descubrimiento. Los defensores de Long pidieron al Congreso de los EE.UU. la declaración de la autoría de Long en este hallazgo, pero el Congreso declinó tomar una decisión oficial. A raíz de la muerte de Long en 1878, el estado de Georgia le erigió una estatua como homenaje al descubridor del uso del éter como anestésico en cirugía en 1842. Por otra parte, y tras suicidarse en 1848, Wells recibió a título póstumo la resolución de la Asociación Dental Americana en 1864 y de la Asociación Médica Americana en 1870 como descubridor de la anestesia de los Estados Unidos.
Aunque el óxido nitroso ha tenido y continúa teniendo su interés en el campo de la investigación cerebral, sin embargo es posible que su uso como anestésico esté llegando a su fin debido a los efectos adversos que puede producir. En la actualidad se estudian nuevos agentes inhalantes como, por ejemplo, el xenón, que no es biotransformado en el organismo, no es tóxico y es más potente como anestésico.
El óxido nitroso tiene propiedades que le han hecho idóneo para otros usos además de los relacionados con la anestesia. Se ha utilizado como gas propelente en envases presurizados. Así es como se usa en la industria alimentaria, es decir, como gas propulsor en los productos de aerosol. El uso típico es para la preparación de nata montada, donde se usan cartuchos llenos con óxido nitroso para convertir la crema en espuma. Ninguna fracción de este gas reacciona durante el proceso. Por esta razón, la emisión a la atmósfera debida al uso de N2O como propelente en aerosoles alimentarios se considera equivalente al consumo de este gas realizado en ese ámbito.
También se usa para aumentar la potencia en motores de combustión. Esta última aplicación se debe a que a altas temperaturas (por encima de 600 ºC), como las que se alcanzan en la cámara de combustión, dos moles de óxido nitroso se descomponen en tres moles de nitrógeno y oxígeno gaseosos. A temperatura ambiente este óxido es bastante estable debido a la elevada energía de activación de la correspondiente descomposición.
Este incremento del número de moles de gas a elevada temperatura aumenta la presión sobre el pistón, produciendo una mayor aceleración.
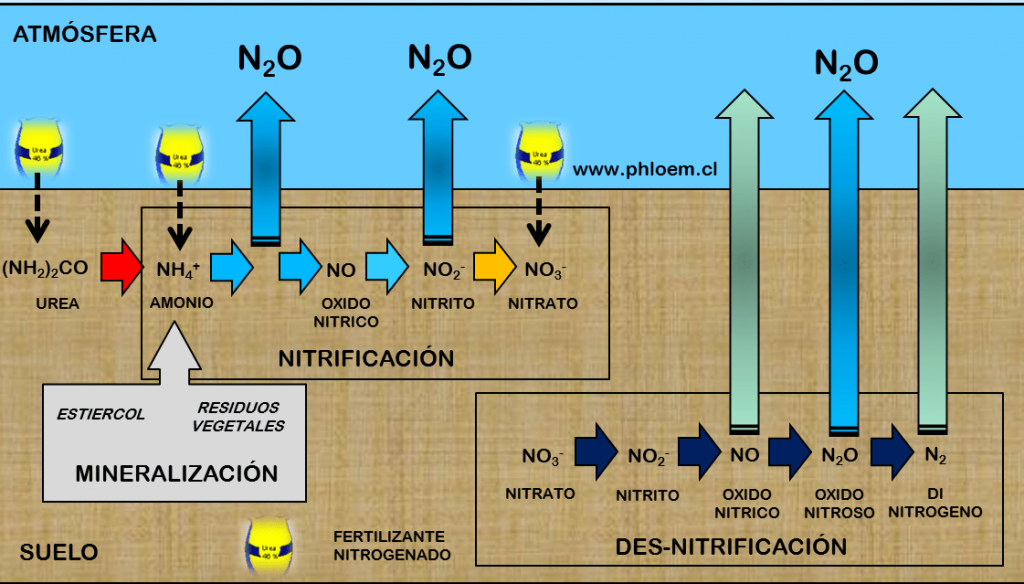
Las fuentes de emisión del óxido nitroso son tanto de origen natural como causadas por la actividad humana.
Las naturales son las asociadas a los siguientes procesos:
– Ciclo del nitrógeno en los procesos biológicos por actividad microbiana en suelos y océanos.
– Desnitrificación del estiércol en los suelos, fundamental para que el nitrógeno vuelva a la atmósfera. El proceso sigue la siguiente secuencia de transformaciones:
nitrato → nitrito → óxido nítrico (NO) → óxido nítroso (N2O) → nitrógeno molecular
– Tormentas y emisiones volcánicas.
En cuanto a las artificiales (aproximadamente el 40 % del total) pueden destacarse:
– Procesos llevados a cabo en agricultura intensiva.
– Quema de biomasa y combustibles fósiles.
– Uso de fertilizantes nitrogenados (procesos de nitrificación y desnitrificación).
– Deforestación.
En lo relativo a su eliminación de la atmósfera, este proceso se produce cuando lo absorben ciertos tipos de bacterias o cuando lo destruyen la radiación ultravioleta o las reacciones químicas.
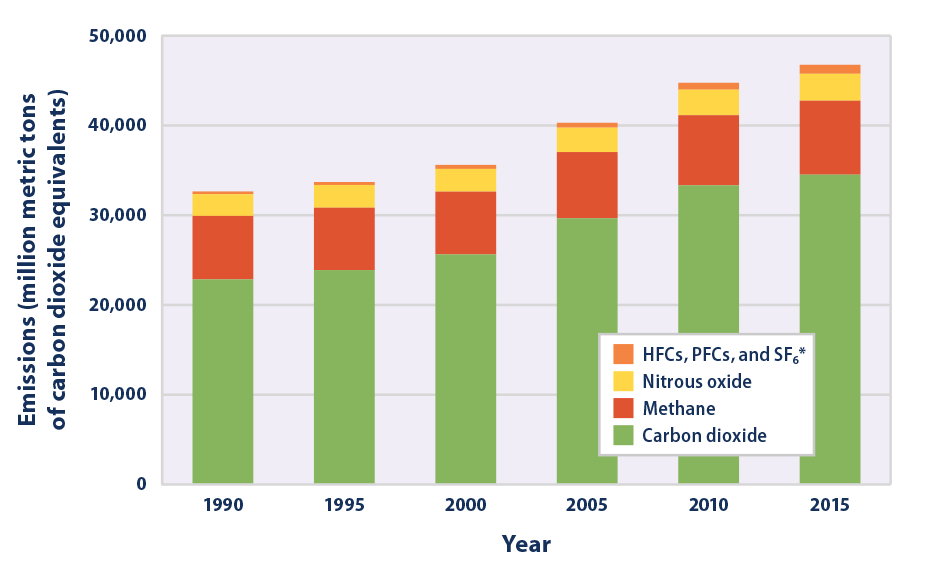
Además de los efectos que la inhalación de este gas causa en el organismo, llegando al cerebro a través de las vías respiratorias y disminuyendo la actividad normal de las neuronas, también su presencia en la atmósfera incide sobre el medio ambiente. Está probado que es un potente gas de efecto invernadero (el tercero en importancia, por detrás de dióxido de carbono y de metano) con una permanencia media de 100 años en la atmósfera; concretamente se le atribuye el 5 % del efecto invernadero de origen artificial. Se estima que el impacto de 1 kilogramo de óxido nitroso sobre el calentamiento de la atmósfera es casi 300 veces el de 1 kilogramo de dióxido de carbono. Estudios recientes han demostrado que las emisiones de este gas han aumentado un 20% a nivel mundial, en comparación con los niveles preindustriales, de 270 partes por mil millones (ppb) en 1750 a 331 ppb en 2018, contribuyendo de manera notable a la imposibilidad de alcanzar los objetivos propuestos en el Acuerdo de París de 2015. Europa es el único continente en el que han disminuido paulatinamente estas emisiones debido a una serie de medidas voluntarias como, por ejemplo, eliminar el N2O de los gases de combustión en la industria del nailon y en otras industrias emisoras del gas.
Por otra parte, actúa con el ozono atmosférico transformándolo en oxígeno molecular y liberando dos moléculas de otro óxido de nitrógeno, el NO, en el proceso. Además, a diferencia de los CFC (clorofluorocarburos), su uso y emisión no están regulados por el Protocolo de Montreal para la protección de la capa de ozono, razón por la que el óxido nitroso es actualmente la principal sustancia que agota dicha capa. Aunque, de acuerdo con estudios realizados por la NASA en los últimos años, para comprender el posible rango de agotamiento del ozono estratosférico que el N2O podría causar durante el siglo XXI, es importante desvincular los escenarios de emisiones de gases de efecto invernadero y comparar diferentes trayectorias de emisiones para sustancias individuales (por ejemplo, emisiones normales de dióxido de carbono frente a bajas emisiones de óxido nitroso).
Sea como fuere ciertamente el óxido nitroso es un gas cuyas consecuencias, las derivadas de cualquiera de sus usos y aplicaciones, en ningún caso deberían conducirnos a la risa.