Ozono: el gran paso para la vida sobre la Tierra
¿Qué es la vida? Este fue el título de las tres conferencias que, en 1943, el físico Erwin Schrödinger, uno de los padres de la mecánica cuántica y galardonado con el Premio Nobel de Física diez años antes, impartió en el Trinity College de Dublín. En 1944 las recopiló en un libro de divulgación que marcó un antes y un después en la reflexión científica sobre el fenómeno vital; varios de sus postulados son plenamente vigentes en la actualidad. En esta obra, Scrödinger se preguntaba acerca de la capacidad de la Física y la Química para explicar los fenómenos espacio-temporales que tienen lugar dentro de los límites espaciales de un organismo vivo. Desde entonces, la Física y la Química han demostrado con creces su contribución sin parangón al estudio que la Biología ha llevado a cabo para dar respuesta a semejante interrogante; interrogante de sencillez solo aparente porque la realidad es que siempre ha alimentado interminables polémicas científicas.
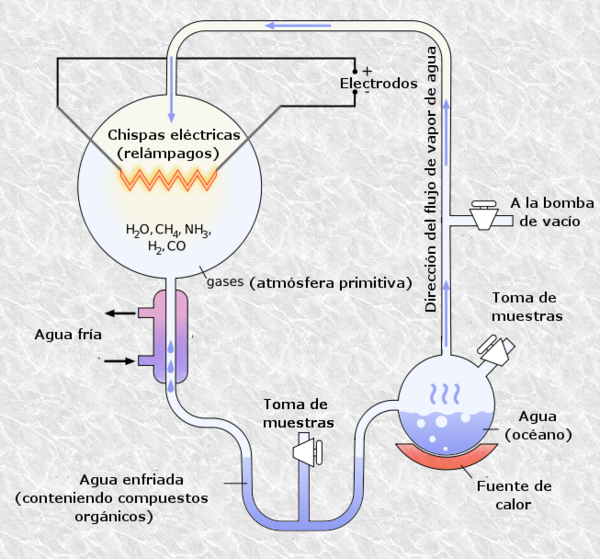
Todos los seres vivos actuales, todos los que nos precedieron y todas las especies futuras a las que nunca conoceremos, tienen su origen en un puñado de moléculas gaseosas muy sencillas, formadas por no más de cinco átomos cada una. Reflexionar sobre este hecho resulta realmente sobrecogedor. Se cree que las primeras moléculas orgánicas surgieron hace unos 4 000 Ma, que eran moléculas muy simples, de muy pocos átomos, y estaban basadas en el elemento carbono. En el transcurso de miles de años e innumerables reacciones químicas diferentes, estas moléculas se combinaron entre sí logrando la síntesis de otras más complejas y más estables. La hipótesis que valida esta teoría reside en las características de la atmósfera primitiva, que contenía gases como amoniaco, metano, vapor de agua y dióxido de carbono; esta combinación de moléculas (“caldo primigenio”) reaccionó merced a la activación energética proporcionada por la radiación ultravioleta y por la gran cantidad de tormentas eléctricas a las que la Tierra primitiva estuvo sometida. Esta hipótesis fue postulada por el bioquímico ruso Alexander Oparin, en 1924, y también por el biólogo británico Sanderson Haldane. En 1953, en la Universidad de Chicago, Stanley Miller y Harold Urey realizaron un experimento con el objetivo de comprobar las ideas de Oparin y Haldane. Determinaron, así, que las moléculas orgánicas podrían haberse formado espontáneamente en condiciones similares a las de la Tierra en sus inicios. Este modelo acerca del origen de la vida postula, además, que las primeras moléculas orgánicas fueron arrastradas por la lluvia hasta el océano primigenio donde se combinaron hasta sintetizar biomoléculas más complejas: proteínas, ácidos nucleicos… Cabe destacar que el autor del siguiente hito relevante en química prebiótica fue Joan Oró, bioquímico nacido en Lleida que llevaba varios años trabajando en la Universidad de Houston; se produjo en 1959 al lograr sintetizar en el laboratorio una de las bases nitrogenadas de los ácidos nucleicos.
Actualmente conocemos al menos un reactor prebiótico natural similar al utilizado por Miller en su laboratorio: la atmósfera de Titán, uno de los satélites de Saturno. Los análisis relativos a la composición y condiciones de su atmósfera, tomados desde telescopios terrestres y por la sonda Cassini-Huygens (2004), conducen a pensar en la posibilidad de que en ese mundo lleguen a originarse sistemas vivos dentro de unos cientos de millones de años.
En la actualidad se barajan varias hipótesis acerca de la abiogénesis (origen de la vida) y de las condiciones físico-químicas que hicieron posible las primeras biomoléculas, siendo las más aceptadas por la comunidad científica la del mundo de ARN (idea original del biólogo molecular Alexander Rich, en 1963) y la del mundo de hierro-azufre (enunciada entre 1988 y 1992 por el químico Günter Wächtershäuser). De acuerdo con la primera, la vida se desarrolló a partir del ARN como molécula primordial cuya actividad química resultó tan versátil que hizo posible la síntesis de proteínas y de ADN, lo que desembocó en la formación de las primeras células. También es destacable que la idea de la vida basada en el ARN volvió a considerarse en 1968 en la obra titulada “El código genético”, del microbiólogo estadounidense Carl Woese, donde, además, hay referencias a LUCA, último antepasado común universal, y a nuestra herencia genética pre-LUCA. Según la segunda de las hipótesis mencionadas, la vida no se originó a través de reacciones químicas en las aguas oceánicas (como Miller, Urey y otros postulaban), sino en la superficie de minerales de hierro y/o azufre próximos a fuentes hidrotermales, bajo condiciones de altas presiones y temperaturas de 100 ºC.
Y en lo concerniente a LUCA, se cree que pudo vivir a partir de hace 3 850-3 700 Ma; y existe bastante consenso en la comunidad científica acerca de que la fecha de aparición de sus primeros descendientes conocidos es de hace unos 3 500 Ma. Desde entonces comenzó la evolución de múltiples formas de vida y la colonización de muy distintos entornos de los océanos, la tierra y el aire. Durante ese largo camino, la vida ha evolucionado sincrónicamente con nuestro planeta, alterando profunda e irreversiblemente sus características.
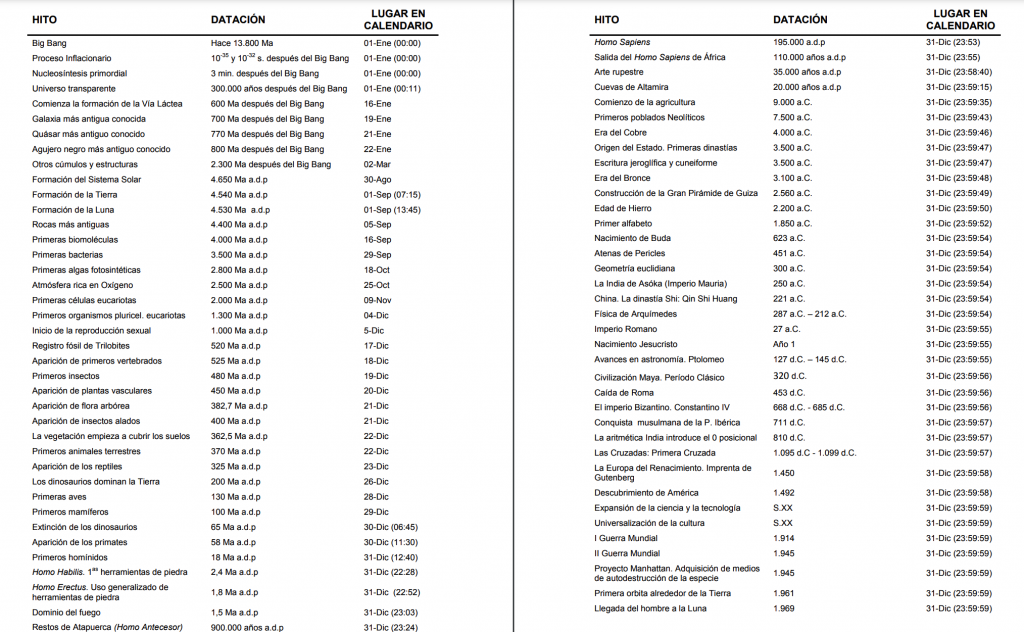
Siguiendo un eje cronológico en lo concerniente a la vida en la Tierra, encontramos que hace 2800 Ma surgieron las primeras algas fotosintéticas, y hace 2500 Ma la Tierra llegó a tener una atmósfera rica en oxígeno. Estos hitos y otros muchos acaecidos desde el origen del Universo, predicho por la teoría del Big Bang, hasta el momento actual, están recogidos en nuestro particular calendario cósmico elaborado por Lali González, profesora de Física y Química en la comunidad de Cantabria, y publicado y alojado en esta web:
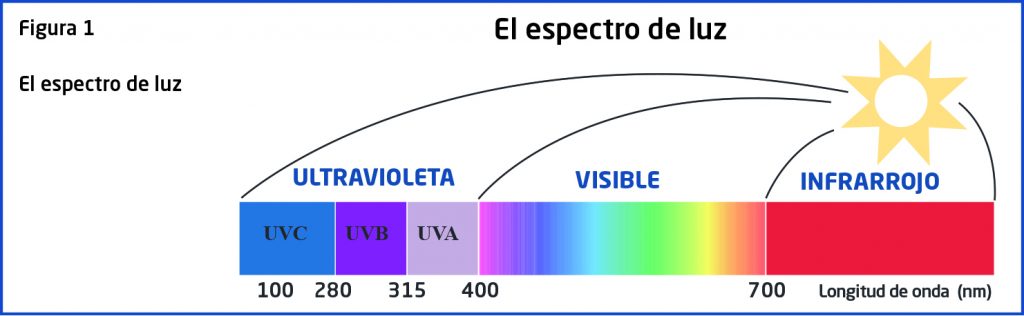
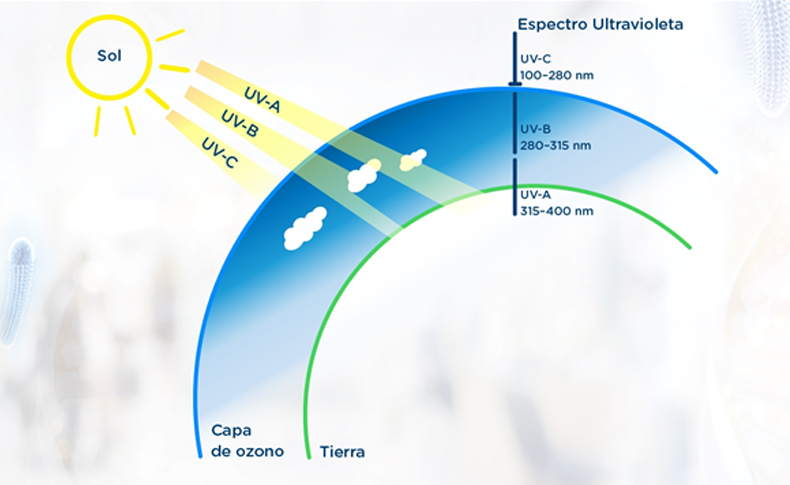
Siguiendo el hilo temporal que nos ofrece el calendario podemos comprobar que la eclosión de la vida sobre tierra firme no se produce hasta hace unos 370 Ma; hasta entonces las expresiones de vida fuera del medio acuático eran realmente escasas. ¿Qué sucedió entonces? La respuesta la encontramos en el ozono atmosférico. Hasta ese momento no existía la suficiente concentración de ese gas que pudiese asegurar la supervivencia de la vida sobre la Tierra. Aunque los niveles de oxígeno en la atmósfera eran próximos a los actuales y la temperatura adecuada para la vida, ello no era suficiente para posibilitar la colonización por las plantas y otras criaturas. Las formas de vida complejas que ya existían en el océano no tenían posibilidades en tierra firme. ¿La razón?: el ozono nos protege de las radiaciones UVB y UVC, que dañan las biomoléculas. Bajo el escudo protector del ozono, la vida comienza a florecer.
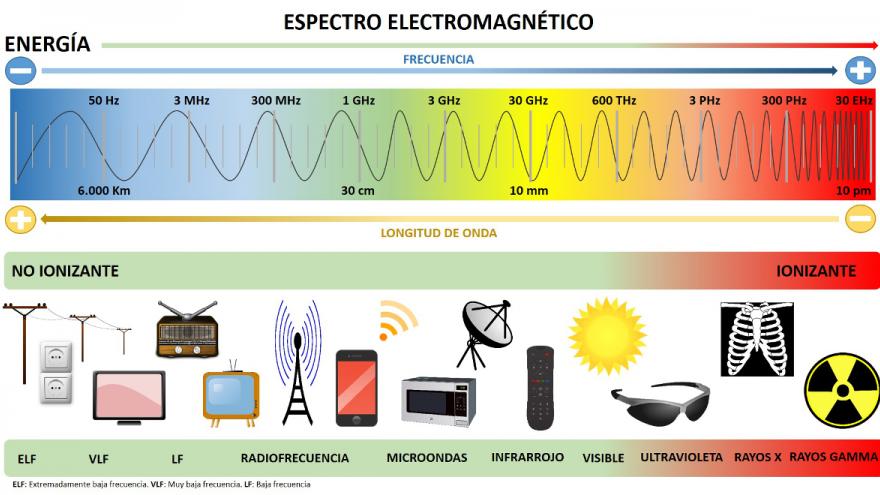
En la historia de nuestro planeta el ozono pudo formarse progresivamente a partir de la liberación del oxígeno a la atmósfera, entre 2 500 y 600 Ma antes de nuestro tiempo. En la estratosfera (desde los 6 km-regiones polares- o 16 km-regiones ecuatoriales- hasta los 50 km de altura sobre la superficie terrestre) el oxígeno se encuentra en dos formas moleculares: el oxígeno normal, O2, y el ozono, O3.
Los procesos químicos que se llevan a cabo en nuestra atmósfera son inducidos por la radiación solar, pero están ligados de muchas maneras a los fenómenos naturales y a las actividades humanas en la superficie terrestre. En los orígenes de nuestro planeta la atmósfera terrestre estaba formada principalmente por los gases que, como ya se mencionó, dieron lugar a las primeras biomoléculas. Es posible que entonces la radiación UV del Sol penetrara la atmósfera, con lo cual se volvió estéril la superficie terrestre. Sin embargo, es probable que la misma radiación UV haya desencadenado las reacciones químicas (quizá debajo de la superficie) que con el tiempo permitieron la vida en la Tierra. Los organismos primitivos utilizaron energía solar para degradar el dióxido de carbono (generado por la actividad volcánica) y obtener el carbono que incorporaron a sus células. El oxígeno es el principal producto secundario de este proceso que se conoce como fotosíntesis. La fotodescomposición del vapor de agua por la luz UV es otra fuente importante de oxígeno. Con el tiempo desapareció gran parte de los gases más reactivos como amoniaco y metano, de modo que nuestra atmósfera actual está formada principalmente por oxígeno y nitrógeno gaseosos. Las concentraciones atmosféricas de estos gases, uno de los cuales es reactivo (oxígeno) y el otro (nitrógeno) es inerte, están determinadas en gran medida por los procesos biológicos.
Formación del ozono
Los científicos dividen a la atmósfera en varias capas de acuerdo con su composición y variación de temperatura. Hasta donde se manifiestan los fenómenos visibles, la región más activa es la troposfera, la capa de la atmósfera que contiene alrededor del 80% de la masa total del aire y casi todo el vapor de agua de la atmósfera; también es la más delgada (10 km). Sobre la troposfera se encuentra la estratosfera, de unos 35 km de espesor, compuesta de nitrógeno, oxígeno y ozono. En esta capa la temperatura aumenta con la altitud, al contrario de lo que sucede en la troposfera. Este efecto de calentamiento se debe a las reacciones exotérmicas provocadas por la radiación UV del Sol. El ozono es uno de los productos de esta secuencia de reacciones y, como ha quedado indicado, sirve para prevenir que los nocivos rayos UV lleguen a la superficie de la Tierra:
La formación de ozono se inicia con la fotodisociación del oxígeno molecular por la radiación solar de una longitud de onda menor de 240 nm (UVC):
Y la posterior combinación de los átomos de oxígeno (muy reactivos) con las moléculas de oxígeno origina el ozono atmosférico:
En esta reacción M es cualquier sustancia inerte, como N2(g). La función que tiene M es crucial: absorbe parte de la energía liberada en el proceso exotérmico anterior e impide, así, la disociación espontánea de las moléculas de ozono. La energía que no absorbe M es liberada en forma de calor. Además, las moléculas de M* regresan por sí mismas al estado basal, liberando más calor al entorno.
Por otra parte, las moléculas de ozono también absorben radiación UV de entre 200 y 300 nm (UVC y UVB):
El proceso continúa cuando el O y el O2 vuelven a combinarse para forma O3, como en la segunda de las ecuaciones anteriores, con lo que se calienta aún más la estratosfera.
La concentración de ozono en la estratosfera es tan baja que si todo ello se lograra comprimir en una sola capa a la temperatura y presión estándar de la Tierra (PTE: 0 ºC y 1 atm), tendría tan solo unos 0,3 cm de espesor (se dice que el ozono total es 0,3 atm-cm o, lo que es lo mismo, 300 UD. La “Unidad Dobson” (UD) se define como 0,001 atm-cm). Sin embargo, es suficiente para filtrar (absorber) la radiación solar entre 200 y 300 nm de longitud de onda. La capa de ozono de la estratosfera es como un escudo que nos protege de la radiación UV más nociva: hace unos 370 Ma permitió que la vida colonizara la superficie terrestre; hoy impide los cánceres de piel, las mutaciones genéticas o la destrucción de los cultivos y otras formas de vegetación.
Destrucción del ozono
La formación y destrucción del ozono por procesos naturales es un equilibrio dinámico que mantiene constante su concentración en la estratosfera. Sin embargo, desde mediados de los años 70, los científicos se han preocupado por los efectos nocivos que en esa capa producen ciertos compuestos denominados genéricamente clorofluorocarbonos (CFC), comercialmente freones. Debido a que son prácticamente inertes, no tóxicos, no combustibles y volátiles, desde su síntesis en los años 30 su uso se generalizó ampliamente como refrigerantes, en la fabricación de productos desechables, como propelentes… Pero la circunstancia de que sean poco reactivos hace que se difundan lentamente hacia la estratosfera sin sufrir cambios; una vez allí se descomponen por la radiación UV de 175 a 220 nm, originando átomos de cloro, extremadamente reactivos, que se combinan con el ozono haciendo que se transforme en oxígeno molecular. Además, sucede que los átomos de cloro no se consumen (actúan como catalizadores) durante el proceso de destrucción del ozono, por lo que cada átomo puede participar en muchas reacciones de ese tipo. Un solo átomo de cloro es capaz de destruir más de 100 000 moléculas de ozono antes de ser eliminado por alguna otra reacción. Además de los CFC hay otros compuestos capaces de destruir el ozono de la estratosfera como, por ejemplo, los óxidos de nitrógeno.
Disminución del ozono en la capa polar
A mediados de la década de los 80 comenzaron a acumularse evidencias de que a finales del invierno se había formado un “agujero en la capa de ozono” del Polo Sur, donde la cantidad de ozono había disminuido en casi un 50%. Durante el invierno, en la estratosfera, se forma una corriente de aire que rodea a la Antártida conocida como torbellino polar. El aire que queda atrapado en este torbellino se vuelve extremadamente frío durante la noche polar, lo cual favorece la formación de partículas de hielo denominadas nubes polares estratosféricas. Esas nubes actúan como un catalizador heterogéneo al proporcionar una superficie para las reacciones en las que algunos compuestos de cloro procedentes de las actividades terrestres se convierten en moléculas de cloro reactivas, las cuales se fotodisocian en átomos de cloro por la acción de la luz solar al comienzo de la primavera. Esos átomos de cloro son los destructores del ozono estratosférico. La situación es menos grave en la región del Ártico porque en esta región, más caliente, el torbellino no dura tanto tiempo.
En 1978, EEUU y algunos otros países prohibieron el uso de CFC en sus aerosoles. Posteriormente, en 1987, la mayoría de los países industrializados firmó un tratado internacional, conocido como Protocolo de Montreal, en el que se establecieron metas para reducir progresivamente, hasta llegar a eliminar, los CFC en 2020. Por otra parte, y aunque aún no está muy claro si los CFC que ya se han liberado a la atmósfera pueden causar daños con consecuencias devastadoras para la vida en la Tierra, es factible retardar la destrucción del ozono reduciendo la disponibilidad de átomos de cloro en la atmósfera; para conseguir esto se han propuesto varias soluciones cuya atención y exposición merecerían un artículo aparte.
Desde el Centro de vuelo espacial Goddard de la NASA se monitorea el “agujero” mediante tres satélites, alguno de los cuales, además, calcula los niveles de cloro que influyen en la destrucción de la capa de ozono. En el link siguiente pueden contemplarse los datos de la NASA en el hemisferio sur relativos a los máximos anuales en la superficie (en millones de km2) del agujero de ozono desde 1979 a 2021, así como los valores mínimos anuales correspondientes a la concentración de ozono en UD. También se observa una segunda tabla con los valores medios anuales para los parámetros anteriores, medidos entre septiembre y octubre.
https://ozonewatch.gsfc.nasa.gov/statistics/annual_data.html
Otros instrumentos de medición del ozono atmosférico son las ozonosondas.

Sonda de ozono transportada por un globo que se acopla a una radiosonda meteorológica convencional.
Desde la NASA han informado acerca de que el agujero de ozono antártico en 2021 alcanzó su máxima superficie el 7 de octubre, catalogándose como el decimotercero más grande desde 1979. Sea como fuere, y avalado por las evidencias científicas durante todos estos años, Paul Newman, científico jefe de Ciencias de la Tierra en el Centro de Vuelo Espacial Goddard, ha afirmado: “Este es un gran agujero de ozono debido a las condiciones estratosféricas más frías que el promedio de 2021, y sin un Protocolo de Montreal, habría sido mucho más grande”.
El Nobel
También las investigaciones relativas a las causas de la disminución del ozono estratosférico, así como a los procesos de formación y descomposición de este gas tan relevante para el establecimiento y mantenimiento de una vida fuera del medio acuático, fueron merecedoras de un Nobel. En 1995 fue otorgado el Premio Nobel de Química conjuntamente a Paul J. Crutzen, Mario J. Molina y F. Sherwood Rowland (de izqda. a dcha. en la imagen), en palabras del comité del Nobel, «por su trabajo en química atmosférica, particularmente en lo que respecta a la formación y descomposición del ozono».
Las investigaciones sobre el ozono atmosférico, así como los científicos responsables, no podían ser merecedores de un menor reconocimiento tras una detenida reflexión acerca del gran paso que el ozono ha supuesto y supone para el hecho vital.